

引言
第二代HyCyte™基因干扰稳转试剂盒 (shRNAx2.0)是基于海星生物的特异SSR重组酶技术开发的基因干扰稳转试剂盒。
产品特点:利用SSR (Site-specific Recombinase)重组酶实现干扰序列DNA载体高效稳转,其次大幅提升了干扰效率。试剂盒可以取代病毒实现基因干扰的稳转株的构建!
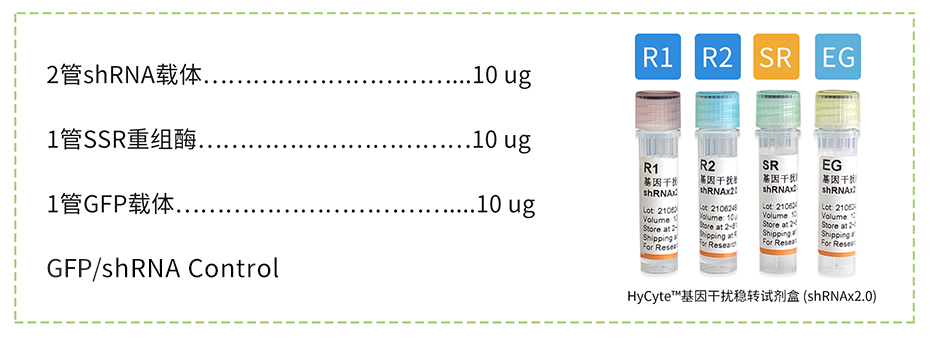
干扰试剂盒包括了人(Human)和小鼠(Mouse)基因组的所有基因的干扰,shRNAx2.0试剂盒包含2个优选的shRNA干扰序列载体、1个表达GFP/对照shRNA干扰序列载体和1管位点特异性SSR重组酶,通过SSR重组酶高效催化shRNA载体整合到细胞的基因组中,实现shRNA片段的细胞稳转效果;同时由于SSR重组酶整合效率极高,shRNA片段在目的细胞的基因组大约含有10~100个拷贝,大幅提升了shRNA片段的表达效果,从而提升了基因的干扰效果。shRNAx2.0载体包含有puro抗性基因和GFP荧光基因,可以轻松通过荧光判断干扰载体的转染效率和表达效率,并通过Puromycin药物进行筛选富集高表达的细胞株,轻松建立基因干扰稳转细胞株。
shRNAx2.0干扰稳转试剂盒的操作与siRNA转染过程一样简单,对分裂细胞和非分裂细胞都有非常好的干扰效果,也适用于间充质干细胞(MSCs)等的基因功能研究。
试剂盒构成
推荐次数
20 次
原理说明
第二代HyCyte™基因干扰稳转试剂盒 (shRNAx2.0)的干扰效率更高,而且操作简单,独有SSR重组酶可以构建高拷贝“稳转”细胞株,并通过药物筛选到高效、稳定的干扰细胞株。所以,shRNAx2.0试剂盒是除了病毒法之外可以轻松获得稳定干扰的稳转细胞株的实验方案。
使用HyCyte™基因干扰稳转试剂盒 (shRNAx2.0)构建干扰稳转株的周期:仅1~2周,便可以拿到长期稳定干扰的细胞株,大幅提升实验速度。
原理图
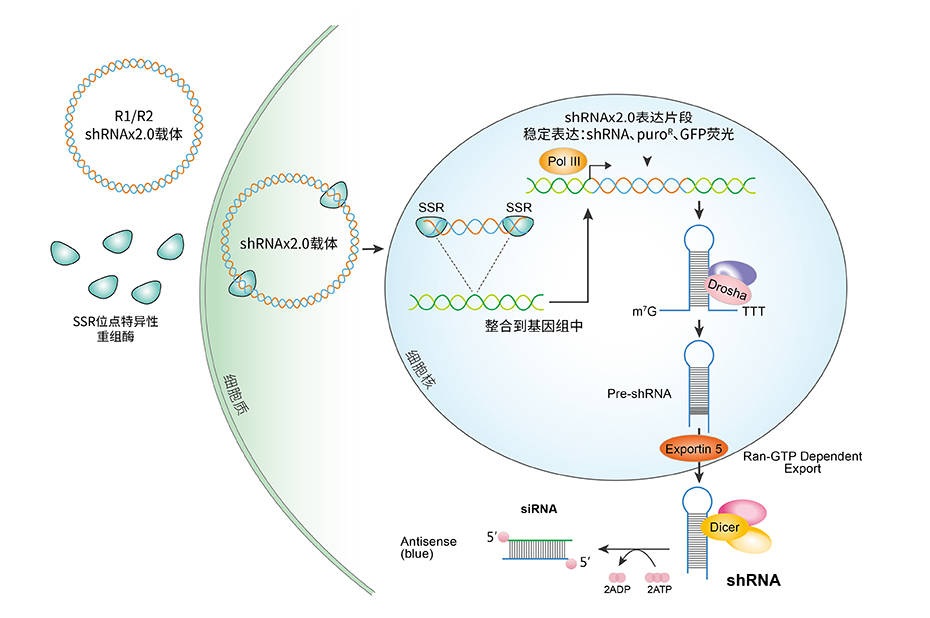
图 1第二代HyCyte™基因干扰稳转试剂盒 (shRNAx2.0)原理
载体结构图

操作流程
第二代HyCyte™基因干扰稳转试剂盒 (shRNAx2.0)的载体和表达对照shRNA/GFP载体均携带有GFP荧光基因,实验过程摸索转染条件可以使用对照质粒,可以按照使用的方法和细胞情况,进行实验条件摸索,建议48小时后的目的细胞的GFP的阳性率不低于50%,shRNAx2.0试剂盒才能获得最佳干扰效果。基因干扰稳转试剂盒 (shRNAx2.0)适用于“脂质体转染法”和“电转化法”。
1. 细胞准备
细胞复苏培养,使用增殖速度快,能够形成良好单克隆的细胞、细胞转染效率高的细胞是实验成功的关键因素,建议满足以下条件:
A. 复苏细胞要传代3次以上;
B. 尽可能使用克隆形成良好的细胞;
C. 转染前2天对细胞进行传代;
D. 转染前单天更换细胞培养基;
E. 转染前保持细胞在汇合度50~85%,使细胞处于最佳增殖状态。
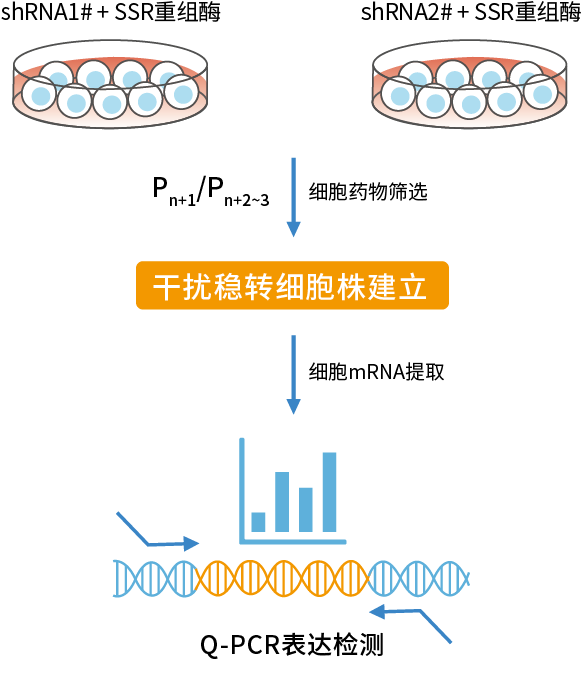
图 2 基因干扰稳转技术流程
2. 细胞转染
2.1 基因干扰稳转试剂盒 (shRNAx2.0)操作步骤(脂质体转染法)
本试剂盒推荐采用转染试剂是Lipofectamine 2000 Reagent (cat#11668-030),具体参照转染试剂说明材料。不同类型的转染试剂,请按照制造商的操作说明进行转染。
注意:悬浮细胞不推荐使用脂质体转染法。
本试剂盒以HEK293细胞24孔板转染为案例进行说明,采用的转染试剂是Lipofectamine® 2000 Reagent (cat#11668-030)。不同转染规格,可以根据不同培养皿的相对表面积的比例配置转染试剂(表1)。
表 1 Lipofectamine® 2000 Reagent转染规格说明

备注:SSR重组酶可以按照DNA量加入
2.2 GFP转染测试:
Lipofectamine 2000转染试剂的转染步骤(24孔板) ,293细胞进行GFP转染:
A. 转染前一天,胰蛋白酶消化细胞并计数(0.5-2×10^5),铺板细胞,使转染当天的密度为80-85%,转染准备前换液成为0.5ml Opti-MEM培养基。(不建议细胞过密进行转染)
B. 准备1.5mL EP管,编号管1,将0.5μg shRNA/GFP表达载体(EG管)溶于50ul Opti-MEM®培养基中混匀。
C. 准备1.5mL EP管,编号管2,将2ul lipo2000溶于50ul Opti-MEM®培养基中混匀。
D. 将管1全部转移到管2中,混匀,室温放置20min。
E. 将上述混合物加入步骤1中的培养细胞中,轻柔地来回晃动培养皿,使混合物均匀分布。
F. 将包含转染复合物和细胞的平板放在组织培养箱(37ºC, 5% CO2)中培养过夜后换成正常的培养基。
G. 培养48小时后观察细胞GFP的表达率,建议GFP阳性率大于50%。
H. 如果GFP的阳性率过低,需要对细胞状态、DNA的转染量(0.5~1ug/24孔)等进行优化。
注意:转染的过程使用的所有的培养基均为无抗生素培养基,否则将导致细胞死亡。

图 3 图 293细胞转染GFP的情况
2.3 shRNA+SSR转染实验:
按照对应的转染试剂操作说明,在完全培养基中分别对2个shRNA/SSR进行转染:
表2 细胞干扰实验组

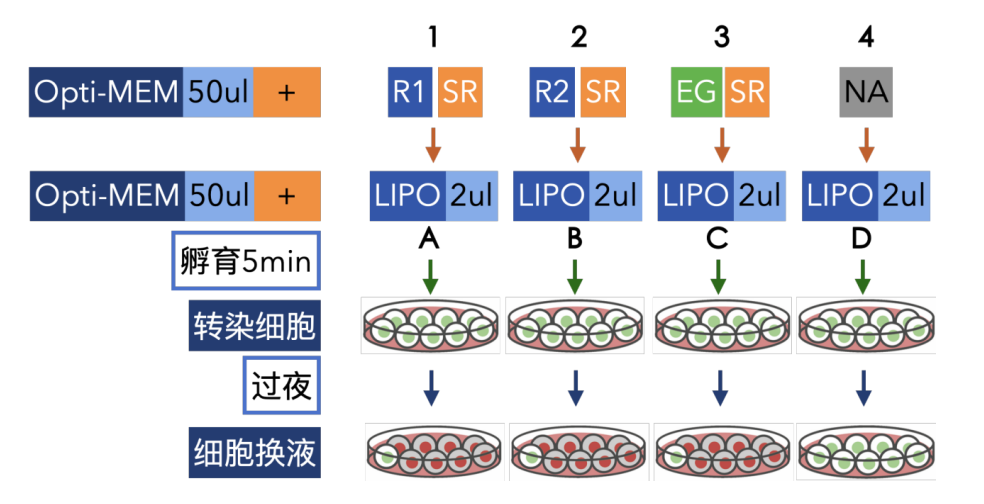
图 4 293细胞转染分组示意图
Lipofectamine 2000转染试剂的转染步骤(24孔板) ,293细胞进行载体转染:
A. 转染前一天,胰蛋白酶消化细胞并计数(0.5-2×10^5),铺板细胞24孔中的4个孔,使转染当天的密度为70-85%,转染准备前换液成为0.5ml Opti-MEM培养基。(不建议细胞过密进行转染)
B. 准备1.5mL EP管,编号管1~4,加入50 ul Opti-MEM培养基,将R1-SR组、R2-SR组、EG(GFP/shRNA)-SR对照组的DNA和酶分别加入1~3到50ul Opti-MEM培养基中混匀。
C. 准备1.5mL EP管,编号管A~D,加入50 ul Opti-MEM培养基,并将2ul lipo2000加入到Opti-MEM培养基中轻柔混匀。
D. 将管1~4分别转移到管A~D中,混匀后,室温放置5 min。
E. 将上述混合物加入步骤A中的培养细胞中,轻柔地来回晃动培养皿,使混合物均匀分布,并做好标记,记录时间。
F. 将包含转染复合物和细胞的平板放在组织培养箱(37ºC, 5% CO2)中培养过夜后,换成正常的完全培养基。
G. 培养48小时后观察细胞GFP的表达率,GFP对照组的阳性率应大于50%。
H. 如果GFP效率符合预期,即可以进入到后续的传代和筛选的步骤。
注意:转染的过程使用的所有的培养基均为无抗生素培养基,否则将导致细胞死亡。
2.2 HyCyte™基因干扰稳转试剂盒 (shRNAx2.0)操作步骤(电转化法)
本试剂盒推荐Neon转染系统,具体参照设备对每种细胞参数。不同类型的电转设备,请按照制造商的操作说明进行优化。
注意:悬浮细胞推荐使用电转化法。
本试剂盒以悬浮细胞K562为案例进行电转化法操作说明,采用的电转仪是Neon (Cat# MPK5000)。
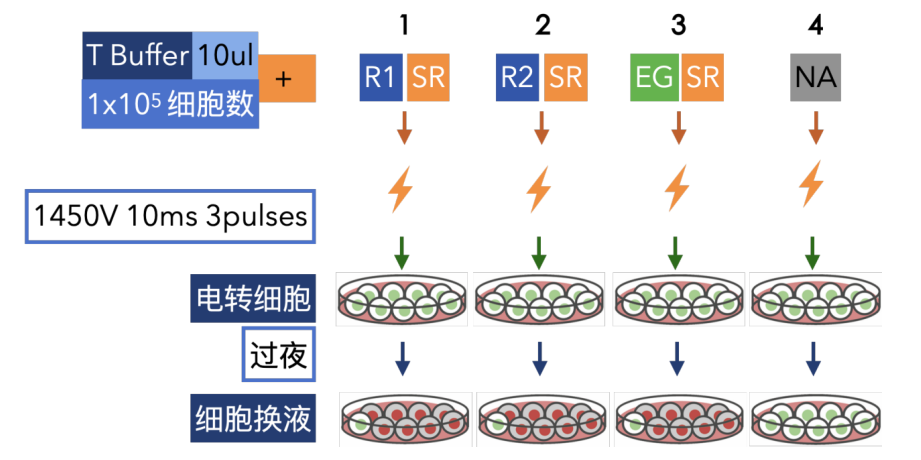
图 5 K562细胞电转示意图
细胞电转染步骤(24孔板) ,K562细胞进行干扰载体转染:
A. K562细胞电转实验使用仪器为 Neon™ 转染仪(Cat# MPK5000),参考官网参数 1450V, 10ms, 3pulses,使用10 μL T Buffer 体系,电转杯缓冲液为 3 mL E Buffer。
B. 向六孔板内加入500ul培养基,放置于培养箱备用。
C. 将0.5 μg shRNA载体和0.5 μg SSR重组酶分别加入 T Buffer中混匀,补齐T Buffer至10 μL(为了保证实验顺利,可以适当增加2ul的T Buffer);
D. 将细胞离心后使用PBS重悬,计数取 1×105cells 至 EP 管内,离心后使用 步骤C中10 μL T Buffer 重悬细胞,轻柔吹打混匀。
E. 在 Neon™ 转染仪界面输入参数 1450 V, 10 ms, 3 pulses,用 Neon™ 移液器吸取 10 μL 细胞悬液。
F. 将 Neon™ 移液器置于电转杯中,点击界面“Start”进行电转。
G. 将电转后的细胞轻柔加入24孔板培养基中,放置培养箱培养48小时,便可以观察细胞的GFP表达按情况。
H. 如果GFP表达符合预期,就可以进入传代和药物筛选步骤。

图 6 K562细胞电转GFP效果图
3. 传代与药物筛选
转染48h后,使用Puromycin(Puro)筛选;细胞汇合度达到80%后,按照1:2~1:3传代,继续药物筛选培养1~2周,即可完成干扰稳转细胞株的构建工作。
备注:Puro的剂量需要通过杀伤曲线来确定,以找出药筛4-7天完全杀伤非转染细胞的最低剂量;嘌呤霉素的药筛范围为1 ~ 10 μg/ml),常规推荐使用浓度约为2 ug/ml,具体操作也可以按照野生型细胞3~5天全部死亡最低浓度为准。
扩增培养的嘌呤霉素常规推荐使用浓度约为1~2 ug/ml进行维持,保证shRNAx2.0载体的表达。
——End——