


MixClone™源自海星生物的技术集成
MixClone™技术可用于快速构建原代细胞、干细胞等困难细胞的基因敲除细胞株。MixClone™技术可以替代RNA干扰技术,成为新一代的基因功能分析工具。可用于大规模的基因功能筛选、基因功能缺失性研究、药物靶点发现、药物靶点验证、基因敲除细胞的体外成瘤性研究以及基因通路相关的细胞信号转导、代谢、增殖\迁移能力等研究。MixClone™极大地简化了基因编辑流程,周期短至四周,价格只有RNA干扰的一半;独有的技术方法和严格的工艺流程控制,基因编辑效率可以高达80-95%,可直接用于下游基因功能分析。
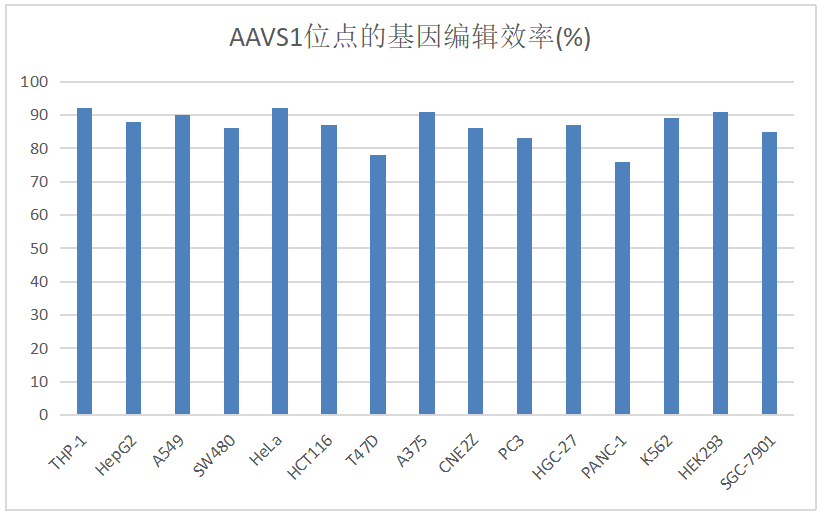
MixClone™技术在不同细胞系上的敲除效率
(AAVS1位点是位于人类基因PPP1R12C第一个内含子上的一段特定序列,被认为是外源基因导入的safe harbor,不影响其它基因的表达。)
与RNA干扰相比,MixClone™技术具有更显著的敲除效果。RNA干扰主要是利用小RNA与mRNA结合,导致靶标mRNA的降解,因而能暂时性地敲低(knockdown)基因的表达水平,敲低水平<70%。在过去十几年中对基因功能的研究发挥着重要的作用,并经常用于大规模功能基因筛选。然而,由于RNA干扰靶向的是每个mRNA的转录产物,因此并不能导致目的蛋白的完全丢失。也正是因为RNA干扰的靶向mRNA的特点,其基因敲低实验经常产生不同的结果,同一小RNA在不同细胞或不同实验重复下,其结果差异比较大,实验重复性不好。RNA干扰还有一个问题就是更容易出现脱靶现象。而MixClone™技术是基于CRISPR/Cas9系统产生的的基因敲除,因而其功能缺失检测数据更为可靠,是新一代的基因功能研究工具。
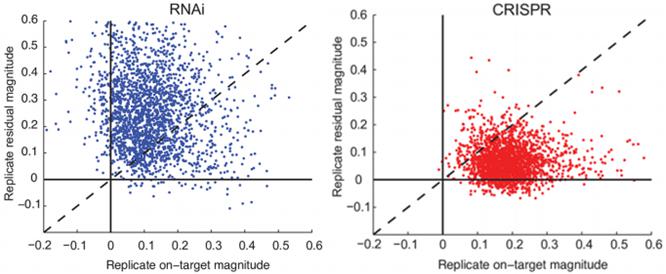
RNA干扰和CRISPR技术的on-target(横坐标)和off-target(纵坐标)相对强度的比较
共分析了1723条sgRNA(右图),其on-target的平均相对强度为0.211,off-target的平均相对强度为0.062,97.4%的sgRNA其on-target的效率要高于off-target的效率(对角线以下的点)。同时分析了924条shRNA(左图)(其靶基因与sgRNA一致),其on-target的平均相对强度为0.197,与sgRNA的效率接近;然而其off-target的平均相对强度为0.230,远高于sgRNA,且只有41.8%的shRNA其on-target的效率高于off-target的效率(对角线以下的点)。这个数据表明与RNA干扰相比,CRISPR技术具有更加高效的基因靶向性,同时脱靶风险更低。
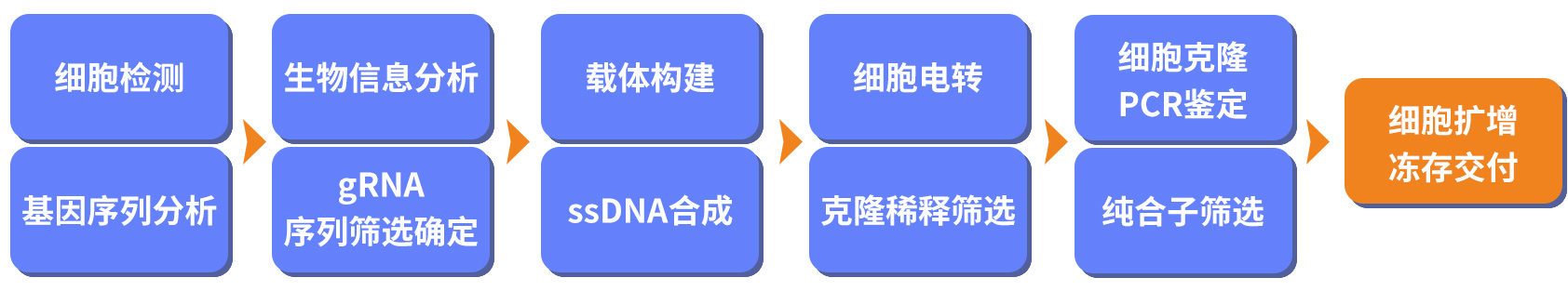
MixClone™的技术流程
MixClone™的交付内容
1. 两管基因敲除细胞,承诺80-95%的基因编辑效率
(一管可以直接用于下游基因功能分析;另一管可以用于单克隆筛选,得到100%敲除效率的纯合单克隆,用于长期研究。)
2. 两管野生型对照细胞
3. 可根据实验需要个性化定制多管细胞
MixClone™技术的实现基础
Smart-optimization™平台
不同细胞株,大小不一样,形态不一样,表面积不一样,其适合的电转参数也不一样。没有两个细胞是一样的,也没有一种protocol适用于所有的细胞。虽然高的电场强度更有利于DNA进入细胞但却会导致细胞死亡,使整体转染效率降低。脉冲持续时间、相同时间内连续的脉冲以及脉冲的波形也会对DNA转染效率和细胞存活率产生影响。我们需要在众多组合中找到高转染效率和高细胞存活率并存的条件。为此我们建立了针对每一种细胞的高通量、自动化的快速优化平台Smart-optimization™。只需要输入细胞系的名称,Smart-optimization™会从各大公开数据库中获取细胞的相关信息,并给出96个电转方案,按综合得分从高到低排列。同时系统会根据收集回来的历史数据判断安排多少组测试性价比高,多时可以一次性测试96个电转条件。细胞电转3天后,进行荧光信号检测,同步收集细胞存活率数据和荧光数据,匹配Smart-optimization™的自动分析系统,可瞬间获取适合的电转参数组合。整个优化过程只需要3天。经过优化后的细胞转染效率平均提高25%。
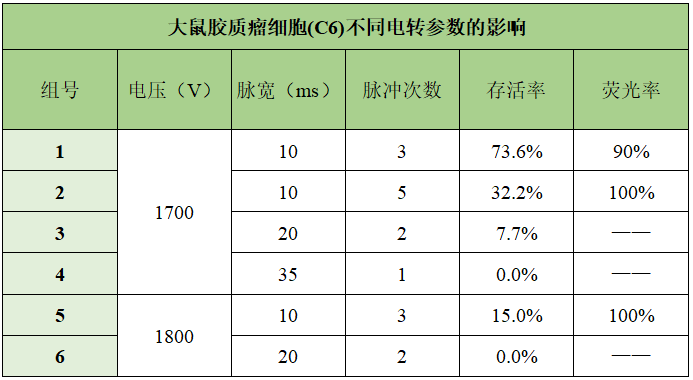
不同的电转参数,电转后细胞的存活率和阳性率差异很大
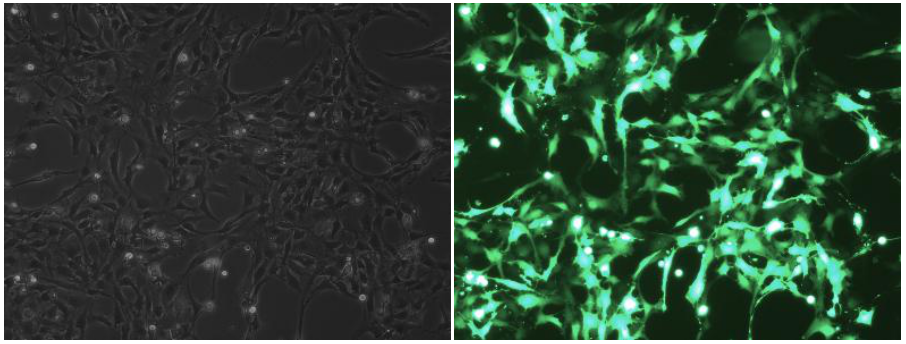
1号组(存活率:73.6%;荧光率90%)
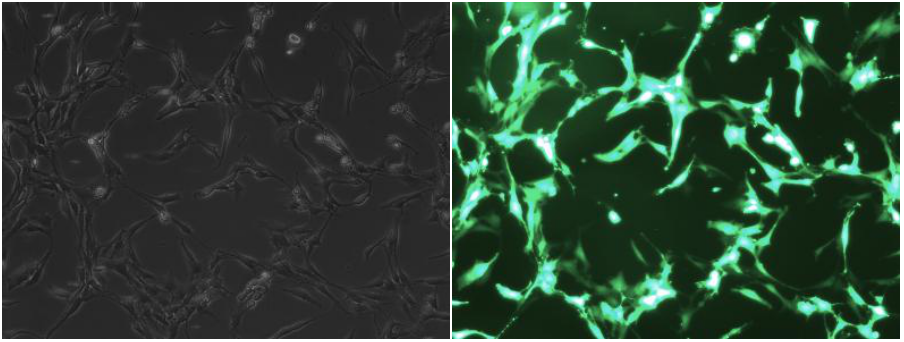
2号组(存活率:32.3%;荧光率100%)
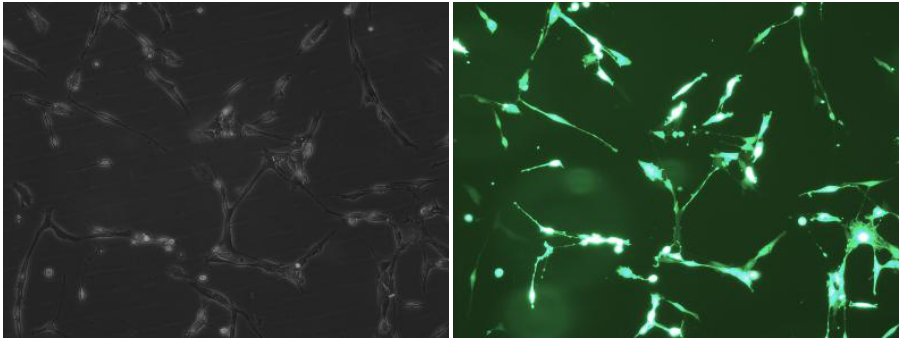
5号组(存活率:15%;荧光率100%)
分子运输载体:
任何的转染技术,外源DNA分子在进入细胞之前,必须实现2个关键过程,一是要使DNA尽可能接触到细胞膜,二是要诱导细胞膜发生可逆变化,使细胞膜瞬间开孔,使外源DNA分子通过细胞膜上的孔洞进入到细胞质中。基于这个技术原理,我们使用特殊分子材料粘附DNA分子,带有正电荷的DNA分子颗粒可以大量吸附到细胞膜表面。在电击作用下细胞膜瞬间开孔,DNA分子由此进入到细胞质中。并且可以有效防止DNA被细胞内的核酸酶快速降解,延长了DNA在细胞内的半衰期,并解决了DNA进入细胞核的障碍。从而大大提高了细胞的转染效率和基因编辑效率。
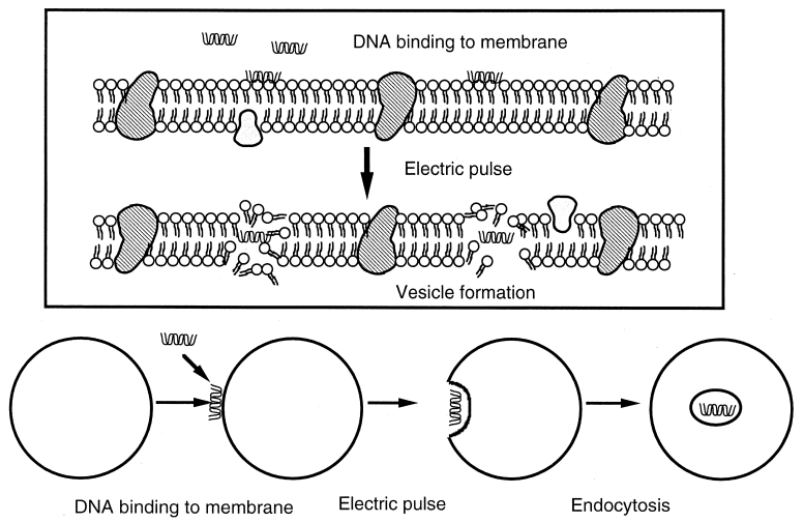
电转染技术运输DNA的过程:1.DNA粘附到细胞膜上;2.电击穿孔;3. 包裹有DNA的囊泡形成;4. DNA被运输到细胞内
促进Cas9蛋白解离的Enhancer
在sgRNA的引导下,Cas9蛋白对靶序列进行切割并产生DSB(双链断裂)。然而Cas9蛋白并不会立即从靶位点DSB上解离下来,反而会非常牢固地结合在靶位点上,其解离过程非常缓慢,会持续6-15小时。由于Cas9蛋白在靶位点DSB上的稳定结合,导致DSB躲过了基因组修复系统的监控,不能对双链断裂进行及时的修复(编辑)。这是影响基因编辑效率的一个重要因素。
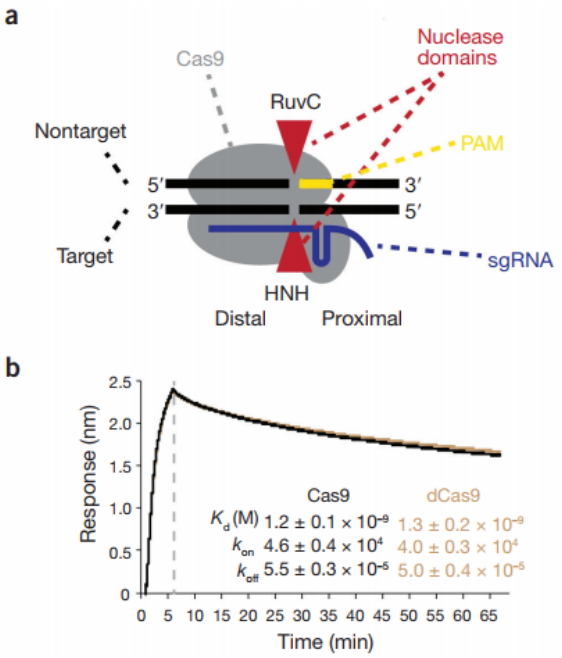
a. Cas9蛋白在靶位点处产生双链断裂(DSB),并稳定结合在靶位点DSB上
b. 体外条件下,Cas9蛋白和靶位点DNA结合的动力学分析:虚线左侧是分子间结合的速度;虚线右侧是分子复合物解离的速度
为此,我们在电转体系中引入一种分子——Enhancer,可以促进非互补链的3’端序列从Cas9蛋白中游离出来,破坏Cas9-DSB结合的稳定性,并招募SSB蛋白(单链结合蛋白)等基因组修复因子,促进对双链断裂位点的修复,因而可以进一步提高基因编辑效率。
智能算法准确计算基因编辑效率
经过Cas9编辑的混合细胞中存在多种基因型,其结果分析被认为是整个工作流程当中比较繁琐的环节。NGS测序是基因组编辑分析的金标准,但是成本高、耗时长。另一种更为常规的做法是,将混合细胞的PCR产物进行亚克隆,挑选几十到上百个单克隆进行测序分析,从中可以统计到混合细胞中所出现的基因型情况及其发生频率。但这项目工作耗时极长、工作量巨大。因此,找到一种快速廉价的结果分析方法是实现MixClone™技术的最后一公里路。
由于混合细胞中存在多种基因型,将其PCR产物直接进行测序的话,切割位点下游的序列将会出现多重套峰,每个套峰间两两组合将可以产生数十亿、数百亿种排列组合,难以确定实际的编辑后序列。
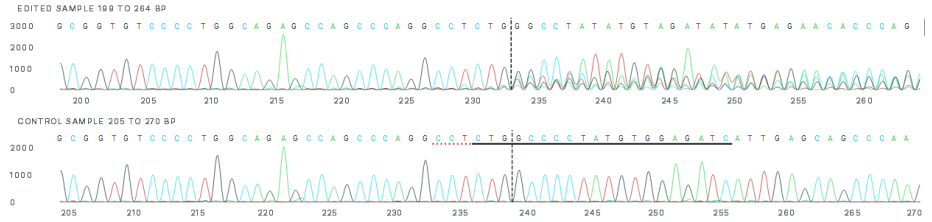
上图:混合细胞中存在多种基因型,PCR产物测序出现套峰
下图:野生型细胞,PCR产物测序单一峰型
为了解决这个问题,我们借助了一套智能化算法来准确计算出混合细胞中的实际基因型。其精确度可以媲美NGS测序,能够对Sanger测序数据进行快速的、具有可重复性的分析,且比NGS成本低100倍。该算法的主要逻辑是:
1. 将sgRNA和野生型序列进行比对,推断预期的切割位点,并根据Cas9基因编辑产生Indel的特点,围绕着预期切割位点,采用标准的非负线性建模,构建一个庞大的模拟编辑序列库。
2. 将预期切割位点上游的野生型序列和实验样品测序结果进行比对,找到二者间不匹配的地方,即找到实际的切割位点,并确定套峰分析区域(实际切割位点上下游的一部分序列)。
3. 将实验样品的套峰分析区域与模拟编辑序列库进行比对,通过非负最小二乘回归,从模拟编辑序列库中找到与实验样品测序图谱吻合的线性组合(即有可能存在于样品中的序列组合)。计算R2,评估二者的拟合度。
4. 由于测序峰图上碱基的峰型高度与该碱基的丰度呈线性相关。因此通过统计每一个位置碱基的峰型高度,可以确定突变位点处碱基在序列总体中的相对丰度。通过标准误差方差-协方差矩阵的二次t检验计算出P值,判定相对丰度评估的显著性。
5. 输出:实验样品的编辑效率;被编辑后的序列以及其在样品中的占比;以及本次分析的可信度。
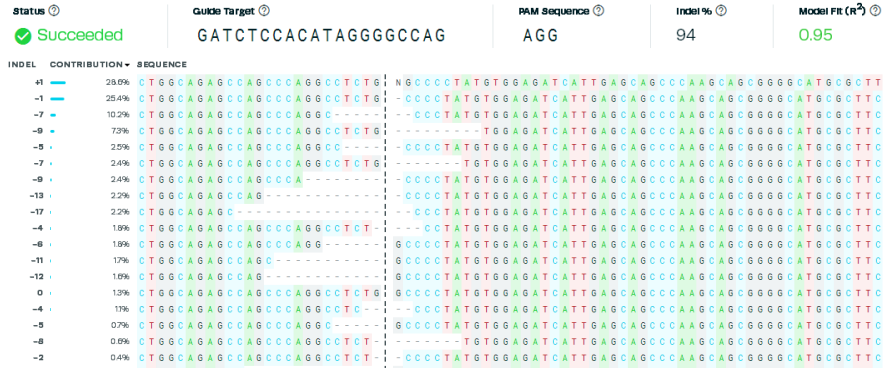
基于测序峰图的智能分析算法
1. 基因编辑效率: Indel%: 94
2. 拟合度R2: 0.95 0.95(拟合度良好)
3. 测序样品中的编辑序列及其所占的比例
| MixClone™基因敲除细胞的应用案例
CAR-T细胞的DGK基因敲除及其抗肿瘤活性分析
实验流程:
Day 1: CRISPR/Cas9转染139 CAR-T细胞,敲除DGK基因
Day 5: 深度测序分析脱靶效应
Day 9: 抗肿瘤活性分析
Day 1: CRISPR/Cas9转染139 CAR-T细胞,敲除DGK基因
使用CRISPR/Cas9技术在139 CAR-T细胞上分别对DGKα基因、DGKζ基因、DGKα和DGKζ双基因(DGKαζ)进行敲除。基因编辑效率(Indel)可以达到80%-90%;移码突变的效率分别为66.7%(αKO 139 CAR-T)和59.6%(ζKO 139 CAR-T)。基因水平的敲除效果分析与蛋白水平检测(Western blot)的结果一致。
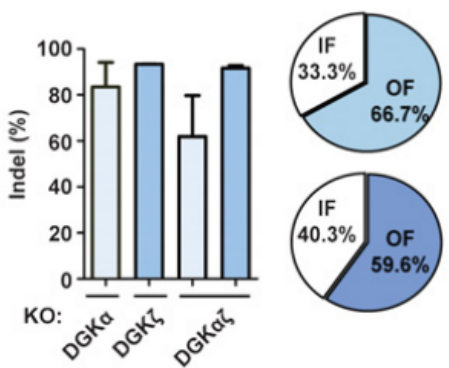
左:基因编辑效率;右:移码突变效率(IF: in-frame; OF: out-of-frame)

Western Blot分析
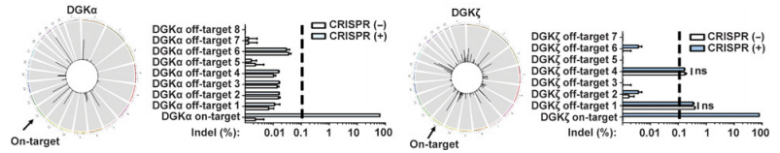
Day 5:深度测序分析脱靶效应
对基因敲除细胞进行深度测序分析(in silico analysis和Digenome-seq),发现无明显的脱靶效应
Day 9: 抗肿瘤活性分析
139 CAR-T细胞的杀伤活性分析
用CellTrace标记的U87vIII肿瘤细胞分别与139 CAR-T细胞(AAVS1 KO、DGKα KO、DGKζ KO、DGKαζ KO)共培养,18小时后,收集细胞,计算U87vIII肿瘤细胞的死亡百分率,进行细胞杀伤活性分析。
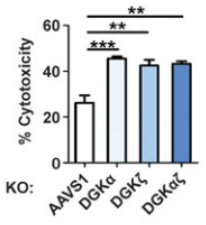
(AAVS1 KO 139 CAR-T细胞作为阴性对照)
实验证明DGK基因敲除的139 CAR-T细胞(DGKα KO、DGKζ KO、DGKαζ KO)比对照CAR-T细胞(AAVS1 KO)有更显著的细胞杀伤作用。
细胞因子浓度水平测定
用CellTrace标记的U87vIII肿瘤细胞分别与139 CAR-T细胞(AAVS1 KO、DGKα KO、DGKζ KO、DGKαζ KO)共培养,18小时后,收集共培养物的上清,对上清中的细胞因子(IL2、IFNγ)含量进行测定。
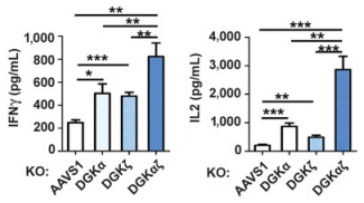
细胞因子分泌量(IFNγ和IL2)的分析
DGKαζ KO双基因敲除的139 CAR-T细胞比DGKα KO或DGKζ KO单基因敲除的139 CAR-T细胞分泌更多的细胞因子IFNγ和IL2,DGKαζ双基因敲除协同促进139 CAR-T细胞的效应功能。
139 CAR-T细胞增殖能力分析
将经CellTrace标记的139 CAR-T细胞(AAVS1 KO、DGKαζ KO)分别与U87vIII肿瘤细胞共培养4天后,收集139 CAR-T细胞,并和新的U87vIII肿瘤细胞共培养1天。通过流式细胞术分析139 CAR-T细胞的增殖情况。
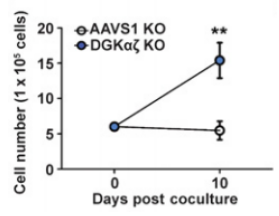
结果表明,在肿瘤细胞的重复刺激下,AAVS1 KO 139 CAR-T细胞进入衰退状态,几乎不增殖;相反,DGKαζ KO 139 CAR-T细胞则越过衰退障碍,成功增殖。
体内肿瘤杀伤活性分析
将1×106的U87vIII肿瘤细胞皮下注射到8周大的NSG小鼠体内,皮下注射后第28天和第32天,分别注射5×106 的139 CAR-T细胞(T细胞、AAVS1 KO 139 CAR-T、DGKαζ KO 139 CAR-T)。在第32天到第35天期间,每天腹腔注射替莫唑胺。每两周测定肿瘤大小。
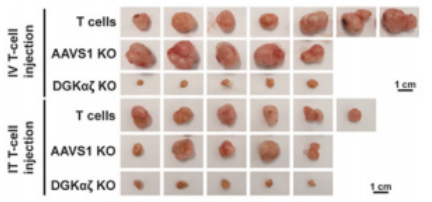
结果表明,在肿瘤异种移植小鼠模型中, T细胞和AAVS1 KO 139 CAR-T细胞均未能控制肿瘤消退。相比之下,在接种后第56天,DGKαζ KO 139 CAR-T细胞可以引起明显的肿瘤消退。
本案例通过CRISPR/Cas9技术敲除DGK基因来提高CAR-T细胞的抗实体瘤能力,为人类癌症免疫治疗提供一种新思路。
本案例也表明MixClone™基因敲除细胞可以用于基因功能缺失性研究、基因通路相关的细胞信号研究、基因敲除细胞的体外成瘤性研究以及细胞增殖能力等研究。具有效率高、周期短、成本低等优势,是新一代的基因功能分析工具。
| 参考文献
Smith I, Greenside PG, Natoli T, Lahr DL, Wadden D, Tirosh I, et al. (2017) Evaluation of RNAi and CRISPR technologies by large-scale gene expression profiling in the Connectivity Map. PLoS Biol 15(11): e2003213.
E. Imai, Y. Isaka. Gene electrotransfer: Potential for gene therapy of renal diseases. Kidney Int., 61 (2002), pp. 37-41
C. D. Richardson, G. J. Ray, M. A. DeWitt, G. L. Curie, J. E. Corn, Enhancing homology-directed genome editing by catalytically active and inactive CRISPR-Cas9 using asymmetric donor DNA. Nat. Biotechnol. 34, 339–344 (2016).
Jung IY, Kim YY, Yu HS, Lee M, Kim S, Lee J. CRISPR/Cas9-mediated knockout of DGK improves antitumor activities of human T cells. Cancer Res. 2018;78(16):4692–703.