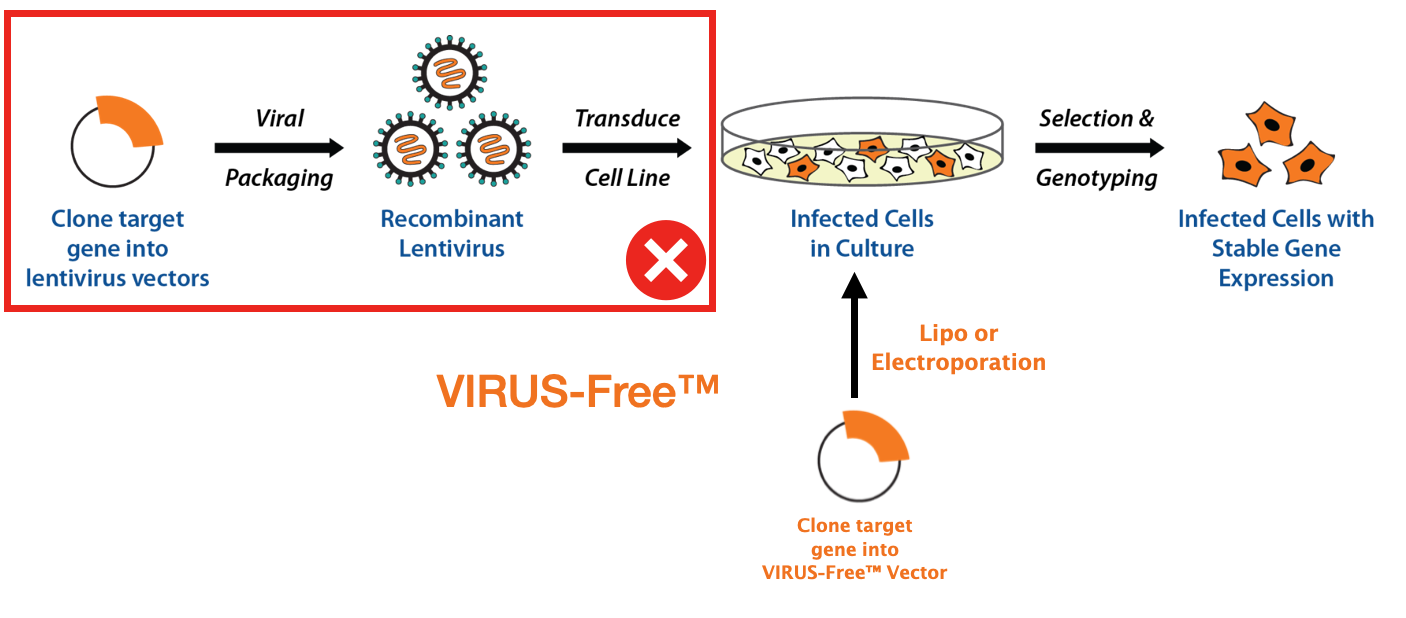
VIRUS-Free™技术优势:无需病毒包装和转染,速度更快,远离病毒
1. 序列完整性好,如果小环的结构被破坏则无法实现基因组插入;
2. 可插入大片段,可以实现上百Kb的BAC片段的插入,而且能够保证其序列完整性,可以进行复杂的基因功能研究;
3. 目的插入效率高,由于通过酶促反应,所以整个反应的过程效率远远高于DNA随机插入效率;
4. 目的基因表达稳定,由于细胞插入的拷贝数相对于病毒来说比较稳定,在稳转株的构建过程中,细胞的表达更加稳定;
5. 实验时间只需要慢病毒系统时间一半,实验更加安全;
6. 可以实现:稳转之后对目的克隆进行检测后可以再将目的基因在原克隆移除,轻松实现加减法的对照。
7. 低成本:无需任何病毒包装的费用。
我们在做任何基因研究的时候都会考虑一个问题:稳定表达某一个基因的细胞株的构建,而为了达到较高的效果,我们尝试了非常多的方法,包括:慢病毒、腺病毒、AAV病毒、仙台病毒等,但是所有的病毒都是一个目标,就是作为载体高效的导入某一基因片段。目前做稳定表达细胞株或者过表达细胞株是基因研究的常用技术方法,同时使用RNA干扰的技术也是通过稳转细胞株的技术来实现,是目前细胞基因研究常见和普遍的技术流程。
我们可以对病毒构建细胞稳转株大致的流程分为:
1. 载体构建(过表达载体/干扰载体);
3. 细胞转染(就是将病毒感染染目的细胞)
4. 药物筛选获得感染细胞纯度的提升;
5. 蛋白或者基因功能研究;
其中的很多过程都是比较熟悉的,而目前这个技术的主要问题“难点”在于:
1. 病毒对于悬浮和敏感细胞不适用;(很多悬浮细胞对病毒转染效果不佳,或者是操作困难,例如:K562、U937等血液和悬浮细胞系;还有就是对病毒极度敏感的细胞,导致细胞死亡,例如:BV2、神经元等神经系统的细胞系)
2. 病毒法对于基因过表达的稳定性极限;(由于基因是通过病毒载体随机插入到目的细胞的基因组中,所有并不是稳定的拷贝数也不是均匀的分布,可以在后续的细胞传代中,拷贝数会不断的被稀释,导致“基因表达量”逐步的下降,特别是在传代超过15代之后,更是如此,此事加药物也不一定能够稳定表达)
3. 病毒法的安全性和成本高;(病毒的操作过程成本较高,一般需要几千元的病毒包装费用,而且都需要2-3周的时间),同时由于病毒的HIV改造特征,对人体的表皮细胞也有一定的感染性,所以需要在生物安全二级实验室操作;
4. 病毒的MOI优化和储存活性问题;(不同的批次的MOI是有差异的,所以每次实验都需要对病毒的MOI进行测试并获得理想的MOI数据,费事费力;其次,病毒在-80度,超过2周就可以检测到滴度的下降;
而如何获得稳定的细胞稳转而且是更加稳定的细胞株就一直是海星生物技术团队思考的问题!这个也是整个基因治疗领域思考的问题。经过了3年的技术研发,我们终于找到了一种“老”技术在应用上的“新”生命。
VIRUS-Free™技术:
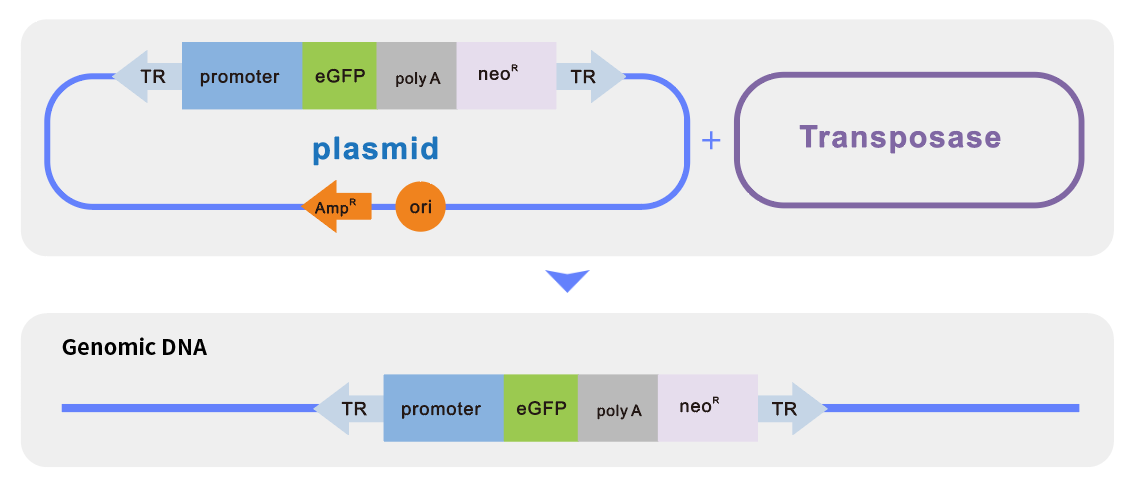
VIRUS-Free™ 是一种利用转座子系统进行细胞稳转株的构建和筛选的技术,而在之前转座子一直都是一个效率不高的代名词,但是经过了海星生物的精心优化,特别是针对TR序列和转座酶的体系的优化,使得VIRUS-Free™技术成为一直能够替代慢病毒感染构建稳转细胞株的技术。其载体中包括了转座子的识别区域,在转座酶的催化下,将目的片段从载体上或者BAC分子上切割下来形成一个小环结构,并在基因组里面的固定序列位置进行插入,从而实现稳转。目前已经在CAR-T细胞治疗中得到较多的临床应用,并充分体现出其:低成本、高效率、基因表达稳定的特点。
技术原理图:
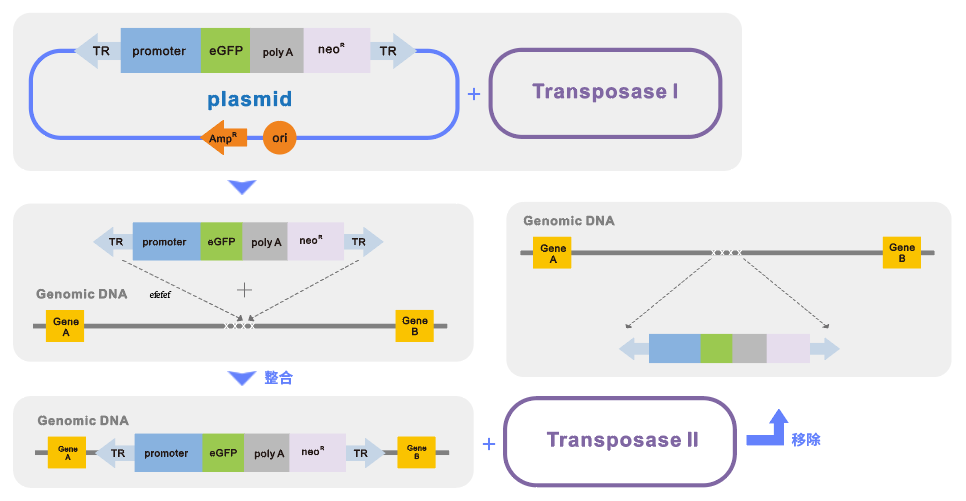
技术流程图: